Le molecole non sono solo somme sui loro atomi costituenti. Ci sono molti diversi tipi di legami che coinvolgono diversi modelli nella sovrapposizione degli orbitali degli elettroni e che influenzano i livelli di energia che questi elettroni possono occupare: presumo che il video QP che hai visto spieghi come il "colore" si relaziona ai livelli di energia degli elettroni.
Il caso dell'atomo (simile all'idrogeno) è solo lo scenario più semplice possibile: è effettivamente possibile calcolare esattamente . Gli ioni / atomi con più di un elettrone sono un po ' più complicati, quindi possiamo solo approssimarli. Gli elettroni negli orbitali interagiscono non solo con il nucleo (che può essere approssimato per essere una carica puntiforme per il nostro scenario), ma anche tra loro - e questa è la parte difficile. Ora, quando leghi due atomi insieme per formare una molecola, hai aggiunto un altro gruppo di elettroni di cui preoccuparti; si "deformeranno" a vicenda gli orbitali, anche quelli che non sono coinvolti direttamente nel legame (anche se solo leggermente).
Ad esempio, si consideri la molecola di idrogeno "semplice" :
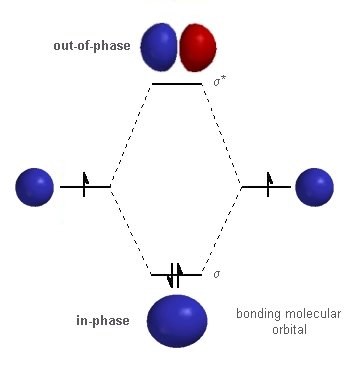
Mentre gli atomi di idrogeno costituenti da soli normalmente hanno orbitali semplici 1s, che sono "sferici", puoi vedere che gli elettroni nella molecola sono in orbitali che sono "schiacciati". Questo ovviamente significa che i livelli di energia che questi elettroni possono occupare sono cambiati, e quindi anche il modo in cui interagiscono con i fotoni incidenti. E questa è solo una semplice molecola, composta da due atomi di idrogeno. Non c'è niente di più facile di così. Ora immagina qualcosa di un po 'più complesso, come i rodopinidi che ci danno una visione monocromatica: quelle sono proteine composte da migliaia di singoli atomi. Anche se solo una piccola parte di questa proteina partecipa effettivamente all'assorbimento della luce incidente, questo evidenzia solo quanto sia complicato per gli scopi del mondo reale.
Allora, perché ci preoccupiamo anche degli spettri degli atomi, quando in natura non troviamo davvero troppi atomi "liberi"? A parte la semplice comprensione della fisica coinvolta, la ragione principale dell'astronomia è il plasma . La superficie di una stella è formata da ioni individuali, non da molecole. Quindi possiamo effettivamente vedere di cosa è fatta la stella osservando il suo spettro. E, naturalmente, non sei limitato a utilizzare solo spettri atomici: puoi notare che quando si determina ad es. la composizione dell'atmosfera di Giove, stiamo effettivamente cercando la "firma" di cose come il metano o l'anidride carbonica - ognuna lascia il suo segno distinto. Allo stesso modo, possiamo distinguere tra atomi di idrogeno e molecole di idrogeno. Allo stesso modo, l'ozono ha uno spettro di assorbimento diverso dalla semplice molecola di ossigeno, motivo per cui l'ozono ci protegge dalla luce ultravioletta mentre il diossigeno no.